
近日,一篇发表于国际权威期刊《Acta Ophthalmologica》的综述[1]通过海量文献检索表明,外泌体,尤其是干细胞外泌体在眼科领域的应用已经从实验室的初步探索逐步走向临床应用阶段,展现出巨大的潜力和前景。
外泌体(Exosomes)是一类由活细胞分泌的具有磷脂双分子层结构的囊泡,其内携带RNA、DNA、蛋白质、脂质等多种信号分子,起到细胞间信号传递的作用,从而调控生理病理过程。它可作为眼部疾病早期诊断的生物标志物、潜在的治疗靶点、靶向药物载体,具有很高的临床应用潜力。
特别是来源于干细胞的外泌体,不仅包含丰富的生物活性物质,还具备促进组织修复、减少炎症反应、抑制纤维化等独特的功能。
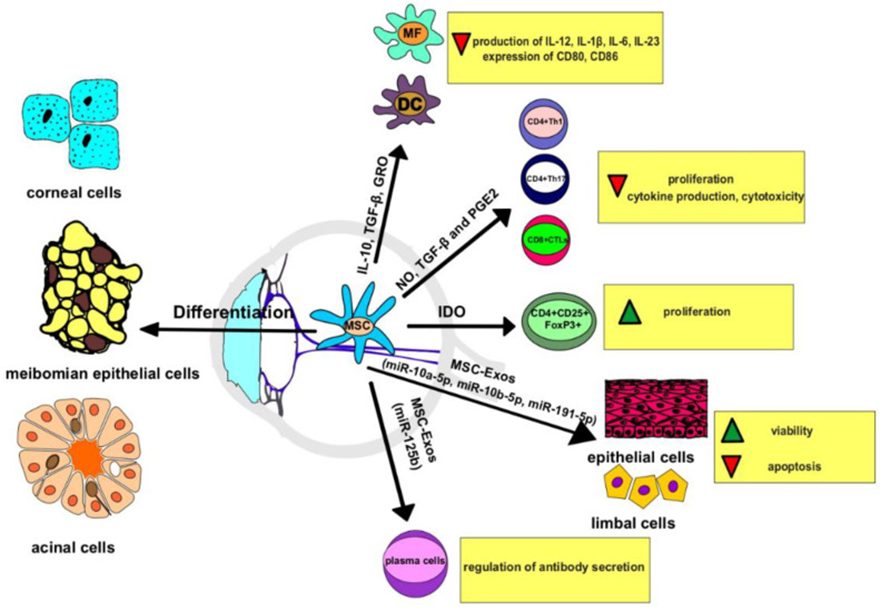
图片来自文献[2]
Stem Cell
干细胞外泌体治疗眼科疾病作用机制
促进组织修复与再生
干细胞外泌体能够携带促生长因子(如VEGF、bFGF等),这些生长因子可以促进角膜和视网膜等组织的修复,通过促进受损细胞的增殖和再生,显示出积极的治疗效果。
抗炎作用
干细胞外泌体通过调节免疫系统,在眼科疾病中展现出显著的抗炎作用。特别是在干眼症和角膜炎等疾病中,外泌体能够有效减轻炎症症状,如刺痛、热和发红等,为患者带来舒缓。
减少纤维化与疤痕形成
眼科手术(如角膜移植、白内障手术等)后常常会出现纤维化和疤痕形成,这不仅影响术后效果,还可能导致视力进一步下降。干细胞外泌体通过抑制纤维化过程,减少疤痕形成,从而有助于组织修复和再生。
精准靶向递送
干细胞外泌体具备较高的靶向性,能够精准地将治疗分子送至病变部位。研究表明,干细胞外泌体能够靶向作用于视网膜的微血管,显著减轻血管渗漏,促进视网膜的血流恢复[2-3]。
干细胞外泌体治疗眼科疾病的临床盘点
目前,关于干细胞外泌体在眼科疾病治疗中的研究已取得显著进展。在基础研究层面,科学家们利用多种动物模型,深入探索了外泌体在眼科疾病治疗中的作用机制。
1
干细胞外泌体治疗青光眼
青光眼是全球首位不可逆致盲眼病。据世界卫生组织统计,预估到2040年,全球青光眼患者将增至1.118亿。青光眼是一种视神经退行性疾病,通常与眼内压升高有关,高眼压导致视网膜神经节细胞(RGCs)的丧失,从而引起失明。因此,如何缓解RGCs的损害是青光眼失明预防和治疗的重点。
最近的一项研究[4]利用间充质干细胞对青光眼模型大鼠进行治疗。研究人员将大鼠分成三组,第一组作为健康对照组(n = 5),第二组(n = 30)和第三组(n = 35)为青光眼大鼠模型组,分别通过使用前房内微珠或小梁网的激光凝固术,诱导大鼠眼内压升高。
其中第二组和第三组每周或每月都在玻璃体内注射间充质干细胞衍生的外泌体或成纤维细胞外泌体。
研究结果表明,每周和每月在玻璃体内注射间充质干细胞衍生的外泌体后,促进了RGCs的神经保护作用。
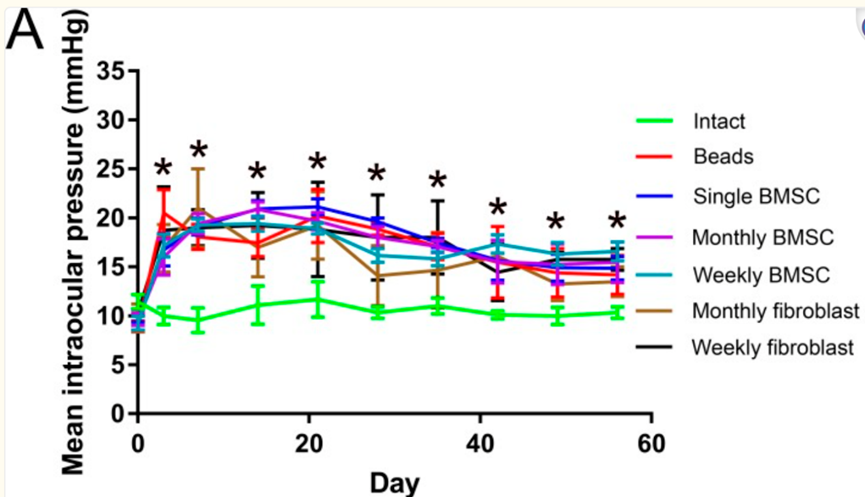
图片来自文献文献[4]
2
干细胞外泌体治疗葡萄膜炎
葡萄膜炎是由虹膜、睫状体、玻璃体、视网膜或脉络膜的炎症引起的疾病。如果不及时治疗,它可能导致不可逆的视力丧失,目前的治疗方法包括免疫抑制疗法和皮质类固醇。然而其疗效不佳且副作用大。目前,干细胞外泌体疗法正在被探索作为葡萄膜炎的潜在治疗方法。
在一项研究中[5],研究人员使用了被诱导患有自身免疫性葡萄膜视网膜炎的大鼠模型。在使用人间充质干细胞外泌体后,显示出保护视网膜的功能,减少T细胞亚群和其他炎症细胞浸润,抑制自身免疫反应。
结果表明,间充质干细胞外泌体通过抑制炎症细胞的迁移有效地改善了葡萄膜炎,表明间充质干细胞外泌体对葡萄膜炎有望成为潜在的新疗法。
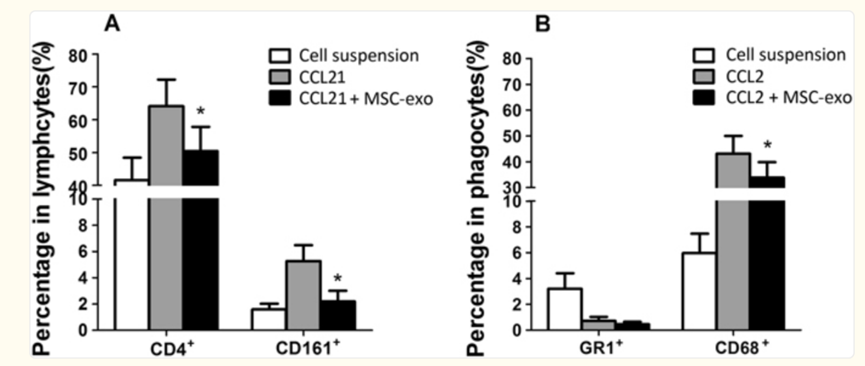
图片来自文献文献[5]
3
干细胞外泌体治疗干眼症
干眼症 (DED),又名角结膜干燥症,是指由泪液分泌不足、蒸发过多或泪液成分异常导致的一种常见且复杂的眼科疾病,可引发眼睛不适症状和视力功能障碍。间充质干细胞被认为是慢性移植物抗宿主病(cGvHD)相关干眼症的一种替代治疗方法。然而,其外泌体是否能发挥相同疗效有待考证。
基于既往研究表明,间充质干细胞衍外泌体具有许多与其来源细胞相同的免疫调节特性的知识。
2019年12月注册了一项评估脐带间充质干细胞(UMSC)外泌体缓解干眼症状疗效的临床试验(NCT04213248)。该试验的目的是分析疾病指标的反应,例如眼泪量和对组织的损伤程度,以滴眼剂形式应用外泌体治疗。

患者将用人工泪液治疗2周,以建立基线,随后用10g/滴的脐带间充质干细胞外泌体治疗14天,每天4次。疾病指标,如泪液分泌量、泪膜破裂时间和组织损伤程度,将在治疗后12周内进行记录和评估。
据悉,这是第一个在眼科疾病领域使用干细胞外泌体的临床试验。如果临床试验成功,将证明干细胞外泌体在眼科疾病治疗中的有效性,为眼科疾病患者带来新的希望。这将是医学领域的一个重大突破,展示了干细胞科技在眼科疾病治疗中的巨大潜力。

参考文献:
[1] Sanghani A, Andriesei P, Kafetzis KN, Tagalakis AD, Yu-Wai-Man C. Advances in exosome therapies in ophthalmology-From bench to clinical trial. Acta Ophthalmol. 2022 May;100(3):243-252. doi: 10.1111/aos.14932. Epub 2021 Jun 11. PMID: 34114746.
[2] Harrell CR, Djonov V, Volarevic V. Therapeutic Potential of Mesenchymal Stem Cells in the Treatment of Ocular Graft-Versus-Host Disease. Int J Mol Sci. 2022 Oct 31;23(21):13254. doi: 10.3390/ijms232113254. PMID: 36362040; PMCID: PMC9656879.
[3]Harrell CR, Volarevic V, Djonov V, Volarevic A. Therapeutic Potential of Exosomes Derived from Adipose Tissue-Sourced Mesenchymal Stem Cells in the Treatment of Neural and Retinal Diseases. Int J Mol Sci. 2022 Apr 19;23(9):4487. doi: 10.3390/ijms23094487. PMID: 35562878; PMCID: PMC9105552.
[4] Mead B, Amaral J, Tomarev S. Mesenchymal Stem Cell-Derived Small Extracellular Vesicles Promote Neuroprotection in Rodent Models of Glaucoma. Invest Ophthalmol Vis Sci. 2018 Feb 1;59(2):702-714. doi: 10.1167/iovs.17-22855. PMID: 29392316; PMCID: PMC5795911.
[5] Bai L, Shao H, Wang H, Zhang Z, Su C, Dong L, Yu B, Chen X, Li X, Zhang X. Effects of Mesenchymal Stem Cell-Derived Exosomes on Experimental Autoimmune Uveitis. Sci Rep. 2017 Jun 28;7(1):4323. doi: 10.1038/s41598-017-04559-y. Erratum in: Sci Rep. 2018 Jun 26;8(1):9889. doi: 10.1038/s41598-018-28151-0. PMID: 28659587; PMCID: PMC5489510.
